Fortschritt in der Herztransplantation
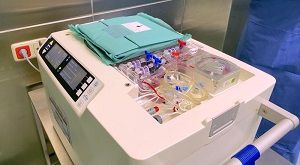
Als erste Klinik in Deutschland setzt das Deutsche Herzzentrum Berlin
(DHZB) ein neuartiges System zur Konservierung von Spenderherzen ein.
Dabei wird das Organ während des Transports über eine Pumpe mit einer
speziellen Nähr- und Konservierungsflüssigkeit versorgt. Die neue Technik
soll eine noch bessere Funktion der Spenderorgane sowie wesentlich längere
Transporte ermöglichen. Nach sehr guten Ergebnissen im Tierversuch erfolgt
nun der Einsatz bei menschlichen Herzen im Rahmen einer Zulassungsstudie.
Die Bestätigung der Leistungsfähigkeit dieses Systems hätte für die
Transplantationsmedizin erhebliche Folgen.
Die Zeit, in der ein Spenderorgan beim Transport von der Spenderin oder
vom Spender zur Empfängerin oder zum Empfänger nicht durchblutet wird,
wird als Ischämiezeit bezeichnet. Sie ist ein wichtiger Faktor für den
Erfolg einer Herztransplantation. Denn von allen Organen, die von einer
Verstorbenen oder einem Verstorbenen zur Spende entnommen werden können,
nimmt das Herz am schnellsten Schaden, wenn es nicht durchblutet wird.
Bislang werden Spenderherzen meist mit einer etwa vier Grad Celsius
kalten, konservierenden Lösung durchspült und in Kühlboxen transportiert.
So können Gewebeschäden zunächst weitgehend zuverlässig vermieden werden.
Dennoch sollte die Ischämiezeit bei Spenderherzen möglichst nicht mehr als
vier Stunden betragen. Die Möglichkeiten bei der Auswahl eines passenden
Organs für Menschen auf der Warteliste sind damit entsprechend
eingeschränkt.
In Schweden wurde jetzt ein neues System entwickelt, das diese
Einschränkung recht umfassend aufheben könnte. Es besteht aus einem neuen
Gerät zum Transport und einer speziellen Lösung zur Konservierung des
Organs und wird nun im Rahmen einer internationalen Zulassungsstudie am
DHZB als erster Klinik in Deutschland eingesetzt.
Das Gerät, genannt „XVIVO Heart Box“, wiegt etwa 25 Kilogramm und ist
etwas größer als ein Umzugskarton. Es enthält im Wesentlichen ein
Kühlsystem, eine Kreislaufpumpe und einen Oxygenator, also vereinfacht
gesagt eine künstliche Lunge.
Vor dem Transport wird das Gerät mit einer neu entwickelten Nähr- und
Konservierungslösung befüllt. Sie besteht unter anderem aus roten
Blutkörperchen, verschiedenen Hormonen, Eiweißen und Humanalbumin, einem
Protein, das im menschlichen Blut sowohl als „Transporter“ für Hormone als
auch als Regulator für den osmotischen Druck dient.
Nach der Entnahme aus dem Körper der Spenderin oder des Spenders wird das
Herz zunächst an die Kreislaufpumpe in der „Heart Box“ angeschlossen und
dann in der Nähr- und Konservierungslösung schwimmend gelagert.
Über die Pumpe in der „Heart Box“ wird das Herz während des Transports
fortlaufend mit der Lösung durchspült. Dabei werden die Herzmuskelzellen
mit Hilfe des Oxygenators in der „Heart Box“ fortlaufend mit frischem
Sauerstoff versorgt. Der Kreislauf wird zur zusätzlichen Konservierung des
Organs auf konstant acht Grad Celsius gekühlt.
Im Tierversuch habe die „Heart Box“ ihre Funktionsfähigkeit bereits
eindrucksvoll unter Beweis gestellt, sagt Herzchirurg Dr. med. Felix
Hennig, der die Studie am DHZB koordiniert: „Schweineherzen nehmen
außerhalb des Körpers noch schneller Schaden als Menschenherzen, dennoch
war selbst nach 24-stündigem Einsatz keinerlei Beeinträchtigung der
Funktionsfähigkeit zu erkennen.“
Das System wurde nun in Rahmen einer internationalen Studie für den
Einsatz am Menschen zugelassen und am DHZB erstmals in Deutschland
eingesetzt.
Die Premiere war aus Sicht der Ärzt*innen ein Erfolg. Das Herz zeigte nach
der Verpflanzung in einen 65-jährigen Berliner eine ausgezeichnete
Funktionsfähigkeit.
Außer dem DHZB beteiligen sich derzeit acht weitere Zentren an Studie. Sie
ist auf mehr als 200 Einsätze ausgelegt und randomisiert, der Einsatz der
„Heart Box“ erfolgt also nach dem Zufallsfaktor.
Die Entwickler*innen und ersten Anwender*innen erhoffen sich von der
Studie die wissenschaftliche Bestätigung mehrerer wesentlicher Vorteile
des Systems:
„Die Möglichkeit deutlich längerer Transportzeiten ohne Schädigung des
Spenderorgans könnte die Anzahl in Frage kommender Spenderorgane für
unsere Patientinnen und Patienten auf der Warteliste deutlich erhöhen“,
sagt Herzchirurg Prof. Dr. med. Christoph Knosalla, chirurgischer Leiter
des Transplantationsprogramms am DHZB; „außerdem könnten wir Organe
akzeptieren, die wir heute ablehnen müssen, da sie auch kürzere Transporte
ohne Sauerstoffversorgung aufgrund verschiedener Faktoren nicht schadlos
überstehen würden.“
Die Mediziner*innen erwarten auch einen besseren Schutz des
Spenderherzens, wenn die Entnahme des erkrankten Organs bei der
Empfängerin oder beim Empfänger besonders zeitaufwändig ist, etwa nach
mechanischer Kreislaufunterstützung oder anderen Voroperationen, so Prof.
Christoph Knosalla. Sein Fazit: „Wir sind sehr zuversichtlich, dass die
Ergebnisse der Studie unsere Einschätzung bestätigen werden, dass die
Transplantationsmedizin hier vor einem großen Fortschritt steht.“





